LEYES DE LOS GASES
CUARTO PERIODO
LEYES DE LOS GASES
LEYES DE LOS GASES


INTRODUCCION
En el dia de hoy explicaremos y trataremos de dar claridad a tus dudas acerca de los gases y las leyes de los gases y la funcion de este asi el lector sabra que metodo se usa en cada situacion
OBJETIVOS
MARCO TEÓRICO
¿QUE ES UN GAS?En el dia de hoy explicaremos y trataremos de dar claridad a tus dudas acerca de los gases y las leyes de los gases y la funcion de este asi el lector sabra que metodo se usa en cada situacion
OBJETIVOS
- Saber diferenciar cada ley
- Poder desarrollar los ejercicios propuestos
- Conocer sus caracteristicas y que los diferencia el uno de el otro
- Aprender las fórmulas de cada una de ellas
- Al hacer ejercicios de estos gases se te haga fácil resolverlos
- Que cada tema te quede con claridad
- Informarte de un nuevo tema
Se denomina gas al estado de agregación de la materia en el que las sustancias no tienen forma ni volumen propio, adoptando el de los recipientes que las contienen. Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras, explicando así las propiedades:
- Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a que se mueven las moléculas.
- Los gases ocupan completamente el volumen del recipiente que los contiene.
- Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
- Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
PROPIEDADES
En los gases, las fuerzas de atracción son casi inexistentes, por lo que las partículas están muy separadas unas de otras y se mueven rápidamente y en cualquier dirección, trasladándose incluso a largas distancias.
Esto hace que los gases tengan las siguientes propiedades:
- No tienen forma propia
No tienen forma propia, pues se adaptan al recipiente que los contiene.
- Se dilatan y contraen como los sólidos y líquidos.
- Fluidez
Es la propiedad que tiene un gas para ocupar todo el espacio debido a que, prácticamente, no posee fuerzas de unión entre las moléculas que lo conforman.
Por ejemplo: Cuando hay un gas encerrado en un recipiente, como un globo, basta una pequeña abertura para que el gas pueda salir.

- Difusión
Es el proceso por el cual un gas se mezcla con otro debido únicamente al movimiento de sus moléculas.
Por ejemplo: un escape de gas desde un balón, este tiende a ocupar todo el espacio donde se encuentra mezclandose con el aire.
- Compresión
La compresión es la disminución del volumen de un gas porque sus moléculas se acercan entre si, debido a la presión aplicada.
Por ejemplo: Se puede observar cuando presionas el émbolo de una jeringa mientras tienes tapada su salida.

- Resistencia
Es la propiedad de los gases de oponerse al movimiento de los cuerpos por el aire. Esto se debe a una fuerza llamada fuerza roce. A mayor tamaño y velocidad del cuerpo mayor es la resistencia.
Por ejemplo: un paracaídas o al elevar un volantín, el roce con el aire impide que el volantín caiga al suelo.

ESTADOS DE AGREGACION
En el estado sólido los átomos o moléculas ocupan posiciones fijas aunque se encuentran vibrando en esas posiciones con una capacidad de movimiento limitada.
En el estado líquido la fuerza de cohesión que mantiene unidas a las moléculas es mucho menor.
En un líquido las moléculas tienen una cierta capacidad de movimiento que, en gran medida, está limitada por las otras moléculas que tienen alrededor.
En un gas las moléculas se encuentran muy lejanas unas de otras y se mueven en todas direcciones con libertad absoluta
|
Antes de entrar de lleno en el estudio de las leyes que explican el comportamiento de los gases , veamos cómo influyen en este los eventos físicos que los alteran y que son: temperatura, presión y volumen.
TEMPERATURA
La temperatura (T) ejerce gran influencia sobre el estado de las moléculas de un gas aumentando o disminuyendo la velocidad de las mismas. Para trabajar con nuestras fórmulas siempre expresaremos la temperatura en grados Kelvin . Cuando la escala usada esté en grados Celsius, debemos hacer la conversión, sabiendo que 0º C equivale a + 273,15 º Kelvin .
¿Cómo se calibra un termómetro?
Mientras se está produciendo un cambio de estado la temperatura permanece constante y por ello consideramos los cambios de estado del agua (a 1 atm) como puntos de referencia.
Punto de fusión del agua:
La fase líquida se encuentra en equilibrio con la fase sólida y la temperatura permanece constante.
Los valores otorgados a este punto en cada escala son:
| |
Punto de ebullición del agua:
La fase líquida se encuentra en equilibrio con la fase gaseosa y la temperatura permanece constante.
Los valores otorgados a este punto en cada escala son:
|
En el intervalo de temperatura comprendido entre los puntos de fusión y ebullición, el agua permanece líquida. Este intervalo se divide en 100 partes en las escalas Celsius y Kelvin, mientras que en la escala Fahrenheit se divide en 180 partes.
| Presión = 1 atm | P.F. del agua | P.E. del agua | Divisiones |
| Escala Celsius | 0 | 100 | 100 |
| Escala Kelvin | 273.15 | 373.15 | 100 |
| Escala Fahrenheit | 32 | 212 | 180 |
| Relación entre las escalas |
| T(K) = T(°C) + 273.15 |
| T(°F) = T(°C)·1.8 + 32 |
Recuerda:
En los cálculos que vamos a realizar en este trabajo SIEMPRE habrá que expresar la temperatura en kelvin.
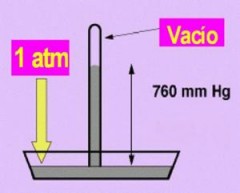 |
| 1 atm es igual a 760 mmHg de presión. |
Presión
En Física, presión (P) se define como la relación que existe entre una fuerza (F) y la superficie (S) sobre la que se aplica, y se calcula con la fórmula
Lo cual significa que la Presión (P) es igual a la Fuerza (F) aplicada dividido por la superficie (S) sobre la cual se aplica.
En nuestras fórmulas usaremos como unidad de presión la atmósfera (atm) y el milímetro de mercurio (mmHg) , sabiendo que una atmósfera equivale a 760 mmHg.

En nuestras fórmulas usaremos como unidad de presión la atmósfera (atm) y el milímetro de mercurio (mmHg) , sabiendo que una atmósfera equivale a 760 mmHg.
Dado que en el Sistema Internacional la unidad de fuerza es el newton (N) y la de superficie es el metro cuadrado (m2), la unidad resultante para la presión es el newton por metro cuadrado (N/m2) que recibe el nombre de pascal (Pa).
1Pa=1Nm2
Otra unidad muy utilizada para medir la presión, aunque no pertenece al Sistema Internacional, es el milímetro de mercurio (mm Hg) que representa una presión equivalente al peso de una columna de mercurio de 1 mm de altura. Esta unidad está relacionada con la experiencia de Torricelli que encontró, utilizando un barómetro de mercurio, que al nivel del mar la presión atmosférica era equivalente a la ejercida por una columna de mercurio de 760 mm de altura.
En este caso la fuerza se correspondería con el peso () de la columna de mercurio por lo que
Como la masa puede expresarse como el producto de la densidad por el volumen (), si sustituimos será:
y dado que el volumen es el producto de la superficie de la base por la altura (), tenemos
y simplificando tenemos:
que nos permite calcular la presión en función de la densidad, la intensidad del campo gravitatorio y la altura de la columna.
Sustituyendo los correspondientes valores en la ecuación anterior tenemos que:
P=d⋅g⋅h=13600kgm3⋅9,8Nkg⋅0,76m≊101300Nm2=101300Pa
Según la teoría cinética, la presión de un gas está relacionada con el número de choques por unidad de tiempo de las moléculas del gas contra las paredes del recipiente. Cuando la presión aumenta quiere decir que el número de choques por unidad de tiempo es mayor.
En este trabajo usaremos la atmósfera (atm) y el milímetro de mercurio (mmHg):
 Volumen
Volumen
Recordemos que volumen es todo el espacio ocupado por algún tipo de materia. En el caso de los gases, estos ocupan todo el volumen disponible del recipiente que los contiene.
Hay muchas unidades para medir el volumen, pero en nuestras fórmulas usaremos el litro (L) y el milílitro (ml). Recordemos que un litro equivale a mil milílitros:
1 L = 1.000 mL
También sabemos que 1 L equivale a 1 decímetro cúbico (1 dm 3 ) o a mil centímetros cúbicos (1.000 cm 3 ) , lo cual hace equivalentes (iguales) 1 mL con 1 cm 3 :
1 L = 1 dm 3 = 1.000 cm 3 = 1.000 mL
1 cm 3 = 1 mL
Cantidad de gas
Otro parámetro que debe considerarse al estudiar el comportamiento de los gases tiene que ver con la cantidad de un gas la cual se relaciona con el número total de moléculas que la componen.
Para medir la cantidad de un gas usamos como unidad de medida el mol .
Un mol es una cantidad igual al llamado número de Avogadro:
1 mol de moléculas= 6,022·1023 moléculas
1 mol de átomos= 6,022·1023 átomos
¡¡¡ 602.200.000.000.000.000.000.000 !!!
La masa molar de una sustancia pura es la masa que corresponde a 1 mol de dicha sustancia:
Como recordatorio diremos que un mol (ya sea de moléculas o de átomos) es igual a 6,022 por 10 elevado a 23:
1 mol de moléculas = 6,022•10 23
1 mol de átomos = 6,022•10 23
LEY DE BOYLE
ECUACIÓN: V1 = P2
V2 P1


Ley de Boyle
Esta ley nos permite relacionar la presión y el volumen de un gas cuando la temperatura es constante.
La ley de Boyle (conocida también como de Boyle y Mariotte) establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante .
La ley de Boyle (conocida también como de Boyle y Mariotte) establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante .
Lo cual significa que:
El volumen de un gas es inversamente proporcional a la presión que se le aplica:
En otras palabras:
Si la presión aumenta, el volumen disminuye.
Si la presión disminuye, el volumen aumenta.
Esto nos conduce a que, si la cantidad de gas y la temperatura permanecen constantes, el producto de la presión por el volumen siempre tiene el mismo valor .
Matemáticamente esto es:
lo cual significa que el producto de la presión por el volumen es constante.
Para aclarar el concepto:
Tenemos un cierto volumen de gas (V 1 ) que se encuentra a una presión P 1 . Si variamos la presión a P 2 , el volumen de gas variará hasta un nuevo valor V 2 , y se cumplirá:
que es otra manera de expresar la ley de Boyle.
LEY DE CHARLES
ECUACIÓN: V1 = V2
T1 T2


Ley de Charles
Mediante esta ley relacionamos la temperatura y el volumen de un gas cuando mantenemos la presión constante.
Textualmente, la ley afirma que:
Textualmente, la ley afirma que:
El volumen de un gas es directamente proporcional a la temperatura del gas.
En otras palabras:
Si aumenta la temperatura aplicada al gas, el volumen del gas aumenta.
Si disminuye la temperatura aplicada al gas, el volumen del gas disminuye.
Como lo descubrió Charles, si la cantidad de gas y la presión permanecen constantes, el cociente entre el volumen (V) y la temperatura (T) siempre tiene el mismo valor (K) (es constante).
Matemáticamente esto se expresa en la fórmula
lo cual significa que el cociente entre el volumen y la temperatura es constante.
Intentemos ejemplificar:
Supongamos que tenemos un cierto volumen de gas V 1 que se encuentra a una temperatura T 1 . Si aumentamos la temperatura a T 2 el volumen del gas aumentará hasta V 2 , y se cumplirá que:
LEY COMBINADA
La ley general de los gases o ley combinada dice que una masa de un gas ocupa un volumen que está determinado por la presión y la temperatura de dicho gas. Estudia el comportamiento de una determinada masa de gas si ninguna de esas magnitudes permanece constante.
Esta ley se emplea para todos aquellos gases ideales en los que el volumen, la presión y la temperatura no son constantes. Además la masa no varía. La fórmula de dicha ley se expresa: (V1 * P1) / T1 = (V2 * P2) / T2 Es decir, el volumen de la situación inicial por la presión original sobre la temperatura es igual a el volumen final por la nueva presión aplicada sobre la temperatura modificada.
La presión es una fuerza que se ejerce por la superficie del objeto y que mientras más pequeña sea ésta, mayor presión habrá
A partir de la ley combinada podemos calcular la forma como cambia el volumen o presión o temperatura si se conocen las condiciones iniciales (Pi,Vi,Ti) y se conocen dos de las condiciones finales (es decir, dos de las tres cantidades Pt, Vt, Tf).
A partir de la ley combinada podemos calcular la forma como cambia el volumen o presión o temperatura si se conocen las condiciones iniciales (Pi,Vi,Ti) y se conocen dos de las condiciones finales (es decir, dos de las tres cantidades Pt, Vt, Tf).
De acuerdo con el enunciado, se puede establecer la siguiente expresión matemática:
V1 . P1 = V2 . P2
T1 T2
En donde:
V= Volumen
P= Presión
T= Temperatura
Observa en los siguientes ejemplos la aplicación de dicha expresión:
1. Una masa gaseosa ocupa u volumen de 2,5 litros a 12 °C y 2 atm de presión. ¿Cuál es el volumen del gas si la temperatura aumenta a 38°C y la presión se incrementa hasta 2,5 atm?
· Primer paso: identificar los datos que brinda el enunciado.
V1= 2,5 L
T1= 12 °C
P1= 2 atm
T2= 38 °C
P2= 2,5 atm
· Segundo paso: Conocer la incognita.
V2= ?
· Tercer paso: Despejar V2 de la expresión V1 . P1 = V2 . P2 , quedando así:
T1 T2
V2= V1 . P1 . T2
T1 . P2
· Cuarto paso: Transformar las unidades de temperatura (°C) a Kelvin.
T1: K= °C + 273 T2: K= °C + 273
K= 12 + 273= 285 K K= 38 + 273= 311 K
· Quinto Paso: Sustituir los datos en la expresión y efectuar los calculos matemáticos.
V2= 2,5 L . 2 atm . 311 K
285 K . 2,5 atm
Se cancelan las unidades de presión y temperatura (atm y K), se obtiene el resultado.
V2= 2,18 L
EJERCICIOS
1.

T1= -219 °C + 273= 54°K
T2= 67,2 °k
V1= 2420 ml
V2= ?
V1 . T2 = V2 . T1
V2 = V1 . T2
T1
V2 = 24020 ml . 67,2 °k
54°k
V2= 3011,55 ml

T1= 724 °C + 273= 997°K
T2= ?
V1= 4,41 L
V2= 1,51 L
V1 . T2 = V2 . T1
T2 = V2 . T1
V1
T2 = 151 L . 997°K
4,41 L
T2= 341,37 °K

T1= 578 °C + 273= 851 °K
T2= 6025,2 °k 8,57 L x 1000 ml = 8570 ml
V1= ? 1 L
V2= 8,57 L
V1 . T2 = V2 . T1
V1 = V2 . T1
T2
V1 = 8570 ml . 851 °k
6025,2°k
V1= 1210,42 ml

T1= -25 °C + 273= 248 °K
T2= -224 °C + 273 = 49 °K
V2= 1240 ml
V1= ?
V1 . T2 = V2 . T1
V1 = V2 . T1
T2
V1 = 1240 ml . 248 °k
49°k
V1= 6275,91 ml

T1= -219 °C + 273= 54°K
T2= 67,2 °k
V1= 2420 ml
V2= ?
V1 . T2 = V2 . T1
V2 = V1 . T2
T1
V2 = 2420 ml . 67,2 °k
54°k
V2= 3011,55 ml
2. LEY DE BOYLE

P1= 3988 mmHg
P2= 1.689 atm 1.689 atm x 760 mmHg = 1283,64 mmHg
V1=2.127 L 1 atm
V2= ?
V1 = P2
V2 P1
P1 . V1 = P2 . V2
V2 = V1 . P1
P2
V2= 2.127 L x 3988 mmHg
1283,64 mmHg
V2= 6,608 L

P1= 828 mmHg
P2= ?
V1=8,812 L
V2= 7,507 L
V1 = P2
V2 P1
P1 . V1 = P2 . V2
P2 = V1 . P1
V2
P2= 8,812 L x 828 mmHg
7,507 L
P2= 971,937 mmHg

P1= 5128 mmHg
P2= 11997 mmHg
V1=?
V2= 356,3 ml
V1 = P2
V2 P1
P1 . V1 = P2 . V2
V1 = P2 . V2
P1
V1= 11997 mmHg x 3563 ml
5128 mmHg
V1= 8,335 ml

P1= 2465 mmHg
P2= 1683 mmHg
V1=2.292 L
V2= ?
V1 = P2
V2 P1
P1 . V1 = P2 . V2
V2 = V1 . P1
P2
V2= 2.292 L x 2465 mmHg
1683 mmHg
V2= 3,356 ml













No hay comentarios:
Publicar un comentario